Một số kết quả nghiên cứu, tiềm năng ứng dụng chế phẩm sinh học Chitosan trong phòng trừ bệnh hại nông sản sau thu hoạch tại tỉnh Bình Dương
TS. Hoàng Ngọc Cương
Khoa Công nghệ sinh học, Trường Đại học Bình Dương
Email: hncuong@bdu.edu.vn
Hiện nay, sản xuất nông nghiệp công nghệ cao là định hướng đối với sự phát triển của tỉnh Bình Dương. Các loại nông sản như: bưởi, cam, quýt, ổi, dưa lưới,… được các doanh nghiệp, hợp tác xã trồng với quy mô lớn, đạt tiêu chuẩn GAP và xuất khẩu đem lại nguồn thu không nhỏ. Tuy nhiên, bệnh trên trái cây, rau quả sau thu hoạch và trong quá trình bảo quản đã và đang gây tổn thất về kinh tế. Các sản phẩm từ khi thu hoạch, bảo quản xuất khẩu bị thiệt hại 20 - 40% tổng sản lượng thu hoạch khi đến tay người tiêu dùng. Các đối tượng gây hại như Nấm Botrytis cinerea (Pers); Monilinia laxa; Phytophthora spp. hoặc vi khuẩn Erwinia spp. gây thối quả trong quá trình bảo quản sau thu hoạch là một trở ngại lớn cho việc vận chuyển và lưu trữ đường dài. Do bào tử phát tán theo gió, mưa nên lây nhiễm vào lá, thân, hoa và quả và bằng cách xâm nhập trực tiếp hay qua vết thương do quá trình thu hoạch.
Biện pháp hiện nay là xử lý thuốc diệt nấm hóa học, tuy nhiên nhận thức cộng đồng về tác động tiêu cực của dư lượng thuốc diệt nấm tổng hợp đối với sức khỏe và môi trường của con người đã thúc đẩy việc bãi bỏ các chất diệt nấm hóa học quan trọng, ngoài ra còn có sự xuất hiện của mầm bệnh kháng thuốc diệt nấm tổng hợp. Do đó, ngày càng có sự quan tâm, tìm kiếm các lựa chọn thân thiện với môi trường thay thế an toàn cho các loại hóa chất diệt nấm hóa học.
Chitosan và các chế phẩm từ chitosan đã và đang được ứng dụng rộng rải trong sản xuất nông nghiệp, với những đặt tính sinh học được nhiều kết quả nghiên cứu minh chứng như: khả năng kháng khuẩn, kháng nấm, kháng oxy hóa, hấp phụ, giải hấp phụ,... và an toàn với người sử dụng. Tuy nhiên, hiệu quả của các hoạt tính sinh học này phụ thuộc vào độ deacetyl (DD) và khối lượng phân tử (Mw) của chế phẩm chitosan được sử dụng. Do đó, việc làm chủ công nghệ sản xuất chitosan là yếu tố quyết định.
Trong báo cáo này, một số kết quả nghiên cứu về công nghệ sản xuất chế phẩm chitosan tại Khoa Công nghệ sinh học, Đại học Bình Dương được trình bày. Các kết quả kháng khuẩn, kháng nấm của chitosan ở điều kiện invitro, invivo đối với vi khuẩn Erwinia spp. gây bệnh thối nhũn và nấm Collectotrium spp. gây bệnh thán thư trên cà chua, xoài cũng được đánh giá. Bài viết giúp Doanh nghiệp, Hợp tác xã,… xuất khẩu nông sản hiểu rõ nguyên nhân gây bệnh trên nông sản sau thu hoạch, một số biện pháp hạn chế và sử dụng chitosan là một trong những lựa chọn an toàn. Tuy nhiên để có thể ứng dụng thực tế, cần có một số nghiên cứu cụ thể trên các đối tượng cần bảo quản.
Từ khoá: chitosan; bệnh thối nhũn; bệnh thán thư
1. ĐẶT VẤN ĐỀ
Bệnh hại nông sản sau thu hoạch đang gây ra những thiệt hại nghiêm trọng cho thu nhập của người nông dân vì làm giảm năng suất và chất lượng nông sản sau thu hoạch như: Bệnh thối nhũn do vi khuẩn, bệnh thán thư do nấm, bệnh thối rễ do tuyến trùng,… Các khảo sát hiện nay cho thấy, bệnh thối nhũn (soft rot) do vi khuẩn, nấm gây hại trên các loại rau củ quả (cà rốt, cà chua, hành tây, khoai tây, ổi, dưa lưới,…) sau thu hoạch làm thất thoát từ 10-30% tổng sản lượng khi đến tay người tiêu dùng. Nghiên cứu cũng cho thấy sự đa dạng các đối tượng gây bệnh thối trên rau quả, trong đó các đối tượng gây bệnh chính như: nấm Botrytis cinerea (Pers); nấm Monilinia laxa; nấm Phytophthora sp. và các vi khuẩn như Erwinia sp., Pseudomonas sp. và Xanthomonas sp. (Hình 1).

Chi phí cho các biện pháp phòng trừ ngày càng gia tăng cho việc sử dụng các chất bảo vệ thực vật nhằm kiểm soát các bệnh trên nông sản sau thu hoạch, đây cũng là nguyên nhân làm tồn dư các chất bảo vệ thực vật, thuốc trừ nấm,… làm mất an toàn thực phẩm nghiêm trọng. Ngoài ra, một số bệnh do nấm gây ra có thể sản sinh độc tố nấm như aflatoxin trên ngô, đậu phộng sau thu hoạch gây ảnh hưởng đến sức khỏe của người tiêu dùng và động vật.
Hiện nay, việc nghiên cứu kiểm soát bệnh hại nông sản sau thu hoạch bằng các chế phẩm sinh học, an toàn đối với người sử dụng và người tiêu dùng được giới khoa học rất quan tâm nghiên cứu. Trong đó, chitosan là polyme sinh học được quan tâm hàng đầu vì có tác dụng kháng khuẩn mạnh và an toàn cho cơ thể con người. Các báo cáo thảo luận về hoạt tính kháng khuẩn của chitosan trong điều kiện khác nhau đã được công bố, hiệu quả kháng khuẩn tùy theo đối tượng vi sinh cần kháng và trọng lượng phân tử, nồng độ, nguồn gốc thu nhận của chitosan thử nghiệm.
Theo Sukmark và cs (2011) chitosan có độ deacetyl trên 95% cho hiệu quả kháng khuẩn tốt đối với cả vi khuẩn Gram âm và Gram dương (E.coli, Salmonella, Staphylococcus aureus, Bacillus subtilis), chitosan có khối lượng phân tử từ 50-80 kDa cho kháng khuẩn tốt nhất [11, 12, 16, 18]. Serano (2000) và Samar (2013) cho thấy rằng chitosan tác động kháng khuẩn lớn khi trọng lượng phân tử thấp (Mw) [13, 14]. Một nghiên cứu khác đã chứng minh rằng hiệu quả kháng khuẩn trên E. coli giảm khi Mw của chitosan tăng [21]. Hơn nữa, nó chỉ ra rằng Mw tối ưu của chitosan để kháng vi sinh là 1,5 kDa. Từ đó cho thấy hoạt tính kháng khuẩn, kháng nấm của chitosan phụ thuộc rất nhiều vào độ deacetyl và khối lượng phân tử của chitosan.
Mục đích của bài tham luận này là đưa ra một số kết quả về công nghệ sản xuất chitosan có độ deacetyl cao và công nghệ này làm chủ quá trình cắt mạch chitosan, từ đó làm chủ công nghệ sản xuất chitosan. Các kết quả thử nghiệm về khả năng kháng khuẩn Erwinia spp. gây bệnh thối nhũn trên cà chua sau thu hoạch và nấm Collectotrium spp. gây bệnh thán thư trên xoài spp. của chitosan cho thấy hiệu quả khá cao. Các kết quả này sẽ làm cơ sở cho các nghiên cứu tiếp theo nhằm làm giảm thiểu tác hại của bệnh đến nông sản sau thu hoạch.
2. GIỚI THIỆU CHUNG VỀ CHITIN, CHITOSAN
Chitin là một trong những polyme sinh học phong phú trong tự nhiên, đóng vai trò là thành phần chính tạo nên độ cứng chắc trong cấu trúc vỏ, khung xương của các loài giáp xác, chân đốt (vỏ tôm, vỏ cua, vỏ ghẹ, vỏ côn trùng), trong mai mực và trong vách tế bào vi nấm, vi khuẩn. Chitosan là một dẫn xuất của chitin được hình thành khi tách nhóm acetyl khỏi mạch chitin (gọi là quá trình deacetyl hoá) nên chitosan chứa rất nhiều nhóm amino (Hình 2). Chitosan thường ở dạng vẩy hoặc dạng bột có màu trắng ngà.
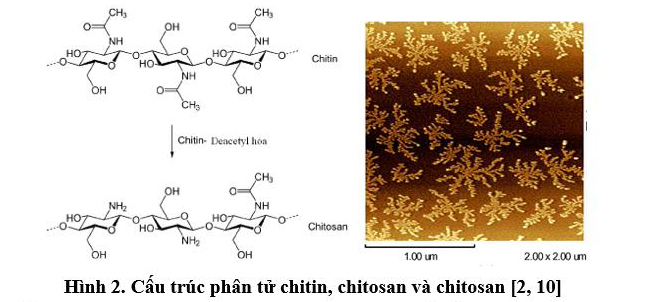
Khối lượng phân tử (Mw) của chitosan là một thông số cấu trúc quan trọng, nó quyết định tính chất của chitosan như khả năng kết dính, tạo màng, tạo gel, khả năng hấp phụ chất màu, đặc biệt là khả năng ức chế vi sinh vật. Chitosan có phân tử lượng càng lớn thì có độ nhớt càng cao. Thông thường, phân tử lượng của chitosan nằm trong khoảng từ 100.000 dalton đến 1.200.000 dalton [4]. Phân tử lượng của chitosan phụ thuộc vào nguồn chitin, điều kiện deacetyl và thường thì rất khó kiểm soát. Chitosan là dạng chitosan có khối lượng phân tử thấp (có độ nhớt thấp từ 30-200 cps) thường có hoạt tính sinh học cao hơn nên có nhiều ứng dụng trong nông nghiệp, y học và công nghệ sinh học.
3. ĐẶC TÍNH KHÁNG KHUẨN, KHÁNG NẤM CỦA CHITOSAN
Các kết quả công bố của Campana (2007) và Kumirska (2010) cho thấy hoạt tính sinh học của chitosan có sự khác nhau là do nhiều nguyên nhân, đầu tiên là do nguồn gốc thu nhận khác nhau, ví dụ như β-chitin từ mai mực và α-chitin từ vỏ tôm cua ghẹ [3, 5]. Thứ hai là do cấu trúc nội bộ liên phân tử như sự tương tác giữa các nhóm amin proton (NH3+) trong mạch chitosan hòa tan trong môi trường axit làm thay đổi khả năng tương tác của chitosan với màng tế bào vi khuẩn do đó ảnh hưởng đến khả năng kháng khuẩn của chitosan [17].
Chitosan có khả năng ức chế nhiều chủng vi sinh vật như vi khuẩn Gram âm, Gram dương và vi nấm. Khả năng ức chế vi sinh vật của chitosan phụ thuộc vào độ deacetyl (DD) và phân tử lượng trung bình (Mw) [4, 7, 9, 15, 22]. Chitosan có độ deacetyl cao trên 85% thì có khả năng kháng kháng khuẩn, kháng nấm tốt. Chitosan có phân tử lượng dưới 2000 dalton thì khả năng ức chế vi sinh vật cao [1, 8, 19]. Chitosan có khả năng ức chế Staphylococcus aureus [6], Bacillus cereus, Escherichia coli và Listeria monocytogenes [8, 15, 20], Botrytis cinerea [1], Bacillus cereus và Bacillus subtilis [15]. Nồng độ ức chế của chitosan phụ thuộc vào loại chitosan và loài vi sinh vật, thường sử dụng trong khoảng 0,0075% đến 1,5%. Ngoài ra, theo No và cs (2002) chitosan cũng làm giảm khả năng sinh độc tố aflatoxin của Aspergillus flavus và Aspergillus parasiticus [117]. Jung (2010) đã nghiên cứu ảnh hưởng của các chitosan có khối lượng phân tử khác nhau đến khả năng kháng khuẩn trên nhiều loại vi khuẩn gram dương và gram âm, kết quả thấy rằng chitosan có khối lượng phân tử thấp có khả năng kháng khuẩn tốt hơn và hoạt tính kháng khuẩn của chitosan mạnh hơn ở vi khuẩn gram âm hơn là vi khuẩn gram dương.
Như vậy, việc chọn loại chitosan có hoạt tính kháng khuẩn tốt là quan trọng trước khi chúng ta tìm hiểu các yếu tố tác động khác có trong vật liệu và điều kiện ảnh hưởng đến hoạt tính kháng khuẩn của chitosan. Nhiều nghiên cứu cho thấy chitosan có hiệu quả trong việc ngăn chặn sự phát triển của vi khuẩn, khả năng kháng khuẩn của chitosan phụ thuộc vào khối lượng phân tử, nồng độ, độ nhớt, loại vi khuẩn. Với 0,1% chitosan có khối lượng 746 kDa có hiệu quả cao trong kháng E. coli. Ngoài ra chitosan có khối lượng phân tử 40 kDa có khả năng ức chế vi khuẩn S. aureus và E.coli ở nồng độ 0,5%.
Hiện tại một số cơ chế đã được đề xuất để quan sát đặc tính kháng vi khuẩn của chitosan và các dẫn xuất. Cơ chế được chấp nhận phổ biến nhất giải thích rằng vách tế bào vi khuẩn tích điện âm dễ dàng phản ứng với phân tử chitosan tích điện dương, làm biến đổi tính thấm tế bào, không cho cơ chất vào tế bào và làm cho các thành phần cấu tạo tế bào thoát ra ngoài, cuối cùng dẫn đến cái chết của vi sinh vật, tác động kháng khuẩn thường diễn ra rất nhanh (trong vài giờ). Thêm vào đó, chúng đều là các chất có khả năng phân giải sinh học và không gây độc đối với tế bào động vật hữu nhũ. Phổ kháng khuẩn của chúng rộng, bao gồm cả vi khuẩn gram âm và gram dương. Tuy nhiên, cần chú ý là khả năng tuyệt vời này bị hạn chế do tính tan hạn chế của chitosan (không tan trong môi trường pH > 7,0). Bên cạnh đó, độ nhớt cao của dung dịch chitosan cũng là một trở ngại, gây kết tụ protein ở điều kiện pH sinh lý.
4. MỘT SỐ KẾT QUẢ VỀ CÔNG NGHỆ SẢN XUẤT CHẾ PHẨM CHITOSAN
Do chitin tồn tại trong nguyên liệu dưới dạng liên kết chặt chẽ với protein, khoáng, chất màu, lipid và các hợp chất khác với hàm lượng biến đổi tùy theo loại nguyên liệu nên để thu nhận chitin thì cần phải khử các hợp chất phi chitin này (Hình 3). Nói chung, quá trình thu nhận chitin bao gồm ba bước: khử protein (deproteinization - DP), khử khoáng (deminaralization - DM) và khử màu (decolorization - DC).
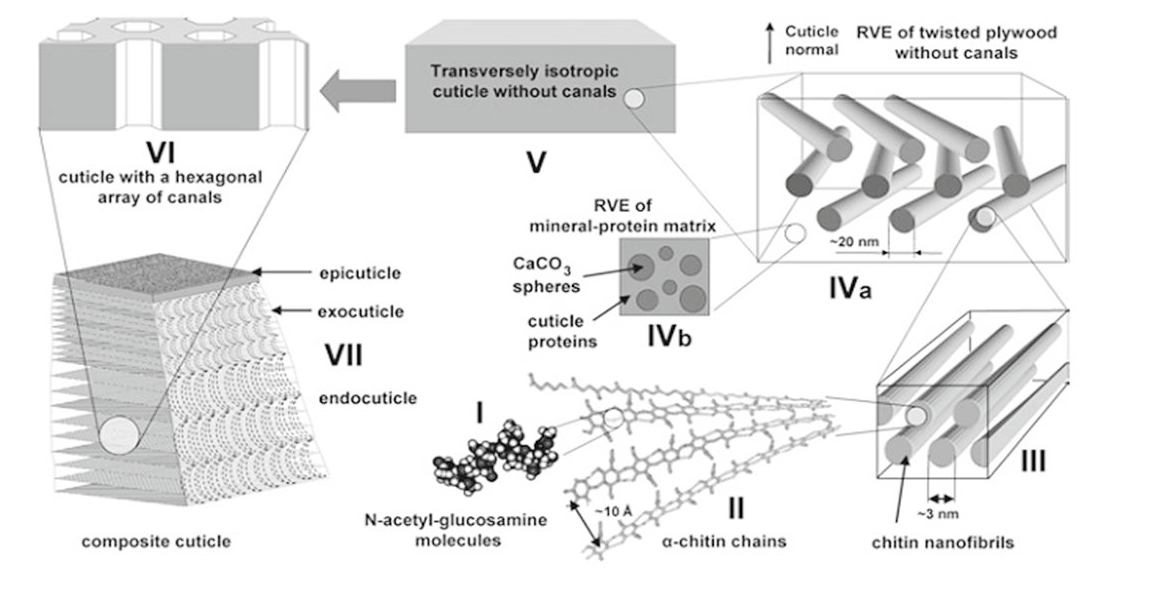
Hình 3. Mô hình cấu trúc chitin trong lớp vỏ tôm [25]
Khi chitin bị khử nhóm acetyl trong cấu trúc hóa học sẽ thu được chitosan gọi là quá trình deacetyl. Các kết quả đã minh chứng, để chitosan có khả năng kháng khuẩn tốt thì độ deacetyl phải trên 90%. Kết quả nghiên cứu tại Khoa Công nghệ sinh học, Đại học Bình Dương đã đề xuất công nghệ cho quá trình deacetyl được trình bày trong Hình 4.
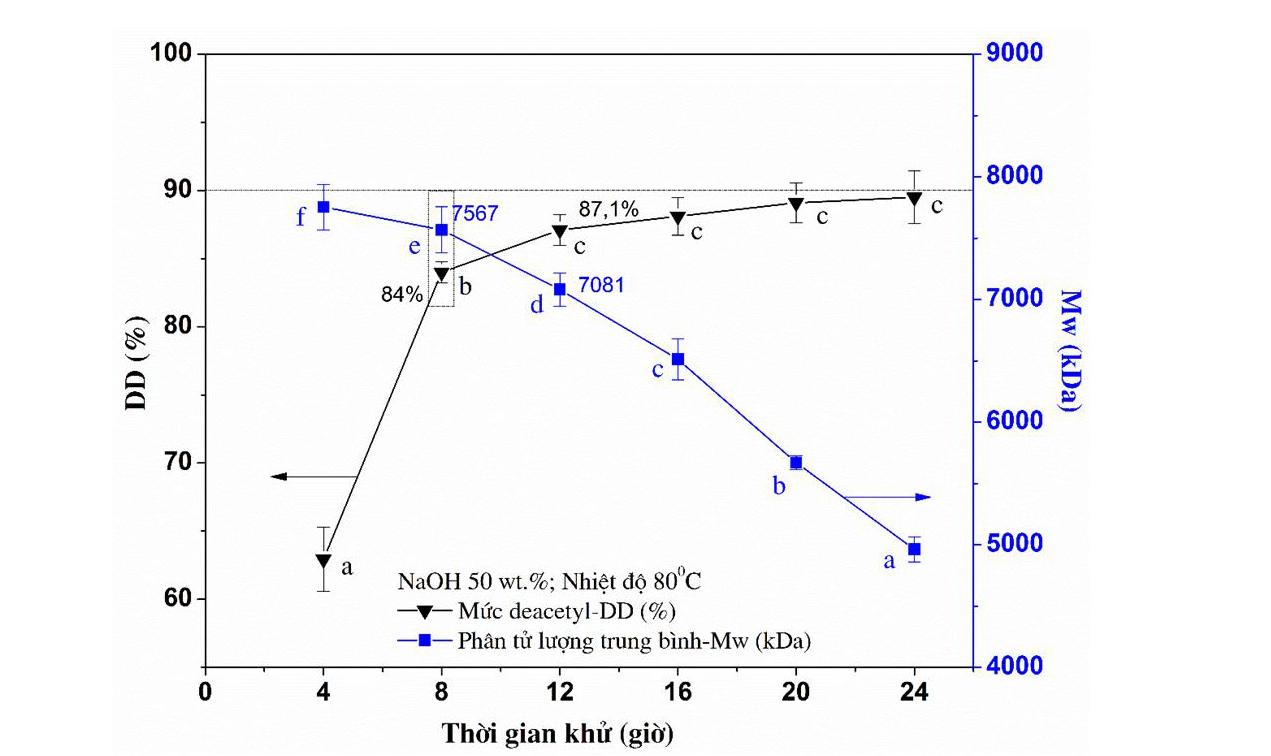
Hình 4. Ảnh hưởng của thời gian khử đến DD và Mw của chitosan
Kết quả nghiên cứu cho thấy, để đạt được sản phẩm chitosan có độ deacetyl trên 90% thì quá trình deacetyl cần thực hiện 2 lần ở nhiệt độ trên 80°C trong môi trường kiềm đặc. Thời gian thực hiện được khống chế chặt chẽ qua 2 bước sau cho hạn chế thấp nhất quá trình cắt mạch chitosan trong quá trình deacetyl. Sản phẩm chitosan sau quá trình deacetyl được đánh giá tính chất được mô tả ở Hình 5 và Bảng 1.

Tính chất bề mặt cấu trúc sản phẩm chitosan được đánh giá qua hình chụp kính hiển vi điện tử SEM được trình bày ở Hình 6. Theo đó, bề mặt cắt của mai mực có các tấm chitin được sắp xếp song song xen kẽ các với các thành phần khác như protein, lipid và khoáng (Hình 6a). Sau quá trình khử thì các tấm chitin vẫn được bảo toàn nhưng độ dày của chúng lại giảm đáng kể (Hình 6b). Điều này có thể giải thích do các thành phần khác như như protein, lipit và khoáng được loại bỏ sau khi xử lý. Trong khi bề mặt β-chitosan trở nên vô định hình và cấu trúc các lớp song song bị phá hủy gần như hoàn toàn (Hình 6c).

Kết quả phân tích phổ hồng ngoại (FTIR) sản phẩm chitosan và một sản phẩm chitosan thương mại có độ deacetyl (DD ≥75%, Sigma Aldrich) được thể hiện trong Hình 7. Các peak đặc trưng của cả hai mẫu đều tương tự nhau tại 3428 cm−1 (O-H), 2928-2872 cm−1 (C-H), 1655 cm−1 (amide I), 1593 cm−1 (amide II), 1318 cm−1 (amide III), và 1028–1070 cm−1 (C-O-C và C-O). Điều này khẳng định hiệu quả của quá trình deacetyl β-chitin, độ tinh khiết của sản phẩm. Kết quả này tương tự với một số công bố về phổ FTIR chitosan của Brugnerotto (2001) và Czechowska-Biskup (2012) [23, 24].
Độ tinh khiết của sản phẩm chitosan được khẳng định thông qua phổ cộng hưởng từ hạt nhân H1-NMR trình bày trong Hình 7. Các peak đặc trưng cho chitosan tại 5.10 ppm (H1), 3.2 ppm (H2), 3.5~3.9 ppm (H3, H4, H5, H6) và 2.0 ppm (NHCOCH3). Không có sự xuất hiện các peak trong khoảng 1,0 và 2,0 ppm chứng tỏ sự tinh sạch của sản phẩm chitosan thu được.
5. TIỀM NĂNG ỨNG DỤNG CHẾ PHẨM CHITOSAN TRONG BẢO QUẢN NÔNG SẢN SAU THU HOẠCH
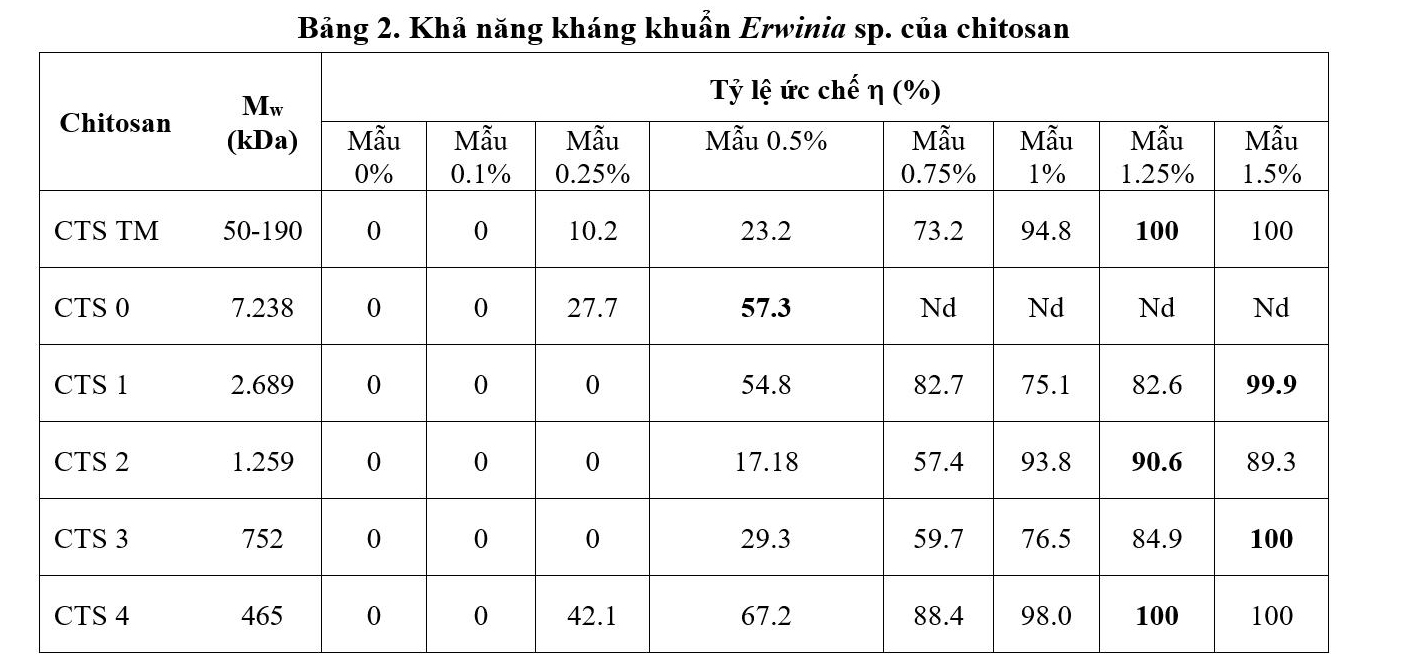
Tác dụng kháng khuẩn Erwinia spp. của các chế phẩm chitosan ở nồng độ và trọng lượng phân tử Mw khác nhau ở điều kiện in vitro được thể hiện trong Bảng 2 và Hình 8. Kết quả cho thấy hiệu quả kháng khuẩn tăng khi nồng độ chitosan tăng và trọng lượng phân tử giảm, khả năng kháng chỉ thể hiện rõ khi các chitosan đạt nồng độ từ 0,5% trở lên. Hiệu quả ức chế 100% khả năng phát triển của Erwinia sp. đạt được đối với chitosan có Mw = 465-752 kDa ở nồng độ 1,25% và 1,5%. So với mẫu chitosan thương mại hiệu quả kháng khuẩn Erwinia sp. đạt 100% ở nồng độ 0,5%. Kết quả này phù hợp với các công bố của Zeng (2003) và Xu (2007) cho thấy khả năng kháng khuẩn hoàn toàn ở nồng độ 1% đối với chitosan có Mw < 500 kDa.
Cơ chế kháng khuẩn của chitosan diệt vi khuẩn Erwinia sp. được mô tả thông qua hình chụp kính hiển vi điện tử truyền qua TEM được mô tả ở Hình 8, 9.
Kết quả kháng bệnh thối nhũn do vi khuẩn Erwinia sp. gây bệnh trên trái cà chua sau thu hoạch được mô tả ở Hình 9. Cho thấy khi xử dụng chitosan có khối lượng phân tử dưới 200 kDa sẽ có khả năng hạn chế bệnh thối nhũn hiệu quả. Hàm lượng polyphenol trong trái cà chua tăng cao sau khi xử lý chitosan nhằm giúp trái cà chua kháng lại bệnh thối nhũn do vi khuẩn Erwinia sp. gây ra (Hình 10).
Kết quả kháng nấm Collectotrium spp. gây bệnh thán thư trên xoài được trình bày ở Hình 12, 13. Kết quả kháng nấm Collectotrium spp. Gây bệnh thán thư trên xoài, ớt.
6. KẾT LUẬN
Các kết quả nghiên cứu cho thấy việc nghiên cứu, ứng dụng các chế phẩm chitosan trong phòng trừ bệnh gây hại trên nông sản sau thu hoạch do vi khuẩn và nấm có tính khả thi cao. Các đặc tính kháng nấm, kháng khuẩn của chitosan thể hiện hiệu quả hay không là do độ deacetyl và khối lượng phân tử của chúng quyết định. Chế phẩm chitosan có tác dụng kháng khuẩn tốt khi sử dụng chitosan có độ deacetyl cao trên 90% và có khối lượng phân tử nhỏ hơn 500 kDa. Do đó, việc sử dụng sao cho hiệu quả là phụ thuộc vào công nghệ sản xuất chitosan. Vì vậy, việc nắm vững quy trình sản xuất chitosan sẽ quyết định hiệu quả của chế phẩm sinh học bày mang lại. Đây cũng là phương pháp bảo quản bằng chế phẩm sinh học nên an toàn với người sử dụng và người tiêu dùng.
TÀI LIỆU THAM KHẢO
1. Badawy M.E., Rabea E.I. (2009), "Potential of the biopolymer chitosan with different molecular weights to control postharvest gray mold of tomato fruit", Postharvest Biology and Technology. 51 (1): p. 110-117.
2. Calvo P., Remunan‐Lopez C., Vila‐Jato J.L., Alonso M. (1997), "Novel hydrophilic chitosan‐polyethylene oxide nanoparticles as protein carriers", Journal of Applied Polymer Science. 63 (1): p. 125-132.
3. Campana-Filho S.P., Britto D.d., Curti E., Abreu F.R., Cardoso M.B., Battisti M.V., Sim P.C., Goy R.C., Signini R., Lavall R.L. (2007), "Extraction, structures and properties of alpha-AND beta-chitin", Química Nova. 30 (3): p. 644-650.
4. Chien P.-J., Sheu F., Lin H.-R. (2007), "Coating citrus (Murcott tangor) fruit with low molecular weight chitosan increases postharvest quality and shelf life", Food chemistry. 100 (3): p. 1160-1164.
5. Kumirska J., Czerwicka M., Kaczyński Z., Bychowska A., Brzozowski K., Thöming J., Stepnowski P. (2010), "Application of spectroscopic methods for structural analysis of chitin and chitosan", Marine drugs. 8 (5): p. 1567-1636.
6. Lavall R.L., Assis O.B., Campana-Filho S.P. (2007), "β-Chitin from the pens of Loligo sp.: Extraction and characterization", Bioresource Technology. 98 (13): p. 2465-2472.
7. Lertsutthiwong P., How N.C., Chandrkrachang S., Stevens W.F. (2002), "Effect of Chemical Treatment on the Characteristics of Shrimp Chitosan", Journal of Metals, Materials and Minerals. 12 (1): p. 11-18.
8. Liu H., Du Y., Wang X., Sun L. (2004), "Chitosan kills bacteria through cell membrane damage", International journal of food microbiology. 95 (2): p. 147-155.
9. Maisuria V.B., Nerurkar A.S. (2013), "Characterization and differentiation of soft rot causing Pectobacterium carotovorum of Indian origin", European journal of plant pathology. 136 (1): p. 87-102.
10. Qi L., Xu Z., Jiang X., Hu C., Zou X. (2004), "Preparation and antibacterial activity of chitosan nanoparticles", Carbohydrate research. 339 (16): p. 2693-2700.
11. Rabea E.I., Badawy M.E.-T., Stevens C.V., Smagghe G., Steurbaut W. (2003), "Chitosan as antimicrobial agent: applications and mode of action", Biomacromolecules. 4 (6): p. 1457-1465.
12. Rhazi M., Desbrieres J., Tolaimate A., Alagui A., Vottero P. (2000), "Investigation of different natural sources of chitin: influence of the source and deacetylation process on the physicochemical characteristics of chitosan", Polymer International. 49 (4): p. 337-344.
13. Samar M.M., El-Kalyoubi M., Khalaf M., El-Razik M.A. (2013), "Physicochemical, functional, antioxidant and antibacterial properties of chitosan extracted from shrimp wastes by microwave technique", Annals of Agricultural Sciences. 58 (1): p. 33-41.
14. Serrano C., Arce-Johnson P., Torres H., Gebauer M., Gutierrez M., Moreno M., Jordana X., Venegas A., Kalazich J., Holuigue L. (2000), "Expression of the chicken lysozyme gene in potato enhances resistance to infection byErwinia carotovora subsp. atroseptica", American journal of potato research. 77 (3): p. 191-199.
15. Shahidi F., Arachchi J.K.V., Jeon Y.-J. (1999), "Food applications of chitin and chitosans", Trends in food science & technology. 10 (2): p. 37-51.
16. Sukmark T., Rachtanapun P., Rachtanapun C. (2011), "Antimicrobial activity of oligomer and polymer chitosan from different sources against foodborne pathogenic bacteria", Kasetsart Journal (Natural Science). 45: p. 636-643.
17. Tolaimate A., Desbrieres J., Rhazi M., Alagui A., Vincendon M., Vottero P. (2000), "On the influence of deacetylation process on the physicochemical characteristics of chitosan from squid chitin", Polymer. 41 (7): p. 2463-2469.
18. Tsai G.-J., Su W.-H. (1999), "Antibacterial activity of shrimp chitosan against Escherichia coli", Journal of food protection. 62 (3): p. 239-243.
19. Wang G.-H. (1992), "Inhibition and inactivation of five species of foodborne pathogens by chitosan", Journal of Food Protection. 55 (11): p. 916-919.
20. Wiśniewska-Wrona M., Niekraszewicz A., Ciechańska D., Pospieszny H., Orlikowski L.B. (2007), "Biological properties of chitosan degradation products", Polish Chitin Society, Monograph. 12: p. 149-156.
21. Xing K., Chen X.G., Kong M., Liu C.S., Cha D.S., Park H.J. (2009), "Effect of oleoyl-chitosan nanoparticles as a novel antibacterial dispersion system on viability, membrane permeability and cell morphology of Escherichia coli and Staphylococcus aureus", Carbohydrate Polymers. 76 (1): p. 17-22.
22. Xu J., Zhao X., Wang X., Zhao Z., Du Y. (2007), "Oligochitosan inhibits Phytophthora capsici by penetrating the cell membrane and putative binding to intracellular targets", Pesticide Biochemistry and Physiology. 88 (2): p. 167-175.
23. Brugnerotto J., Lizardi J., Goycoolea F., Argüelles-Monal W., Desbrieres J., Rinaudo M. (2001), "An infrared investigation in relation with chitin and chitosan characterization", Polymer. 42 (8): p. 3569-3580.
24. Czechowska-Biskup R., Jarosińska D., Rokita B., Ulański P., Rosiak J.M. (2012), "Determination of degree of deacetylation of chitosan-comparision of methods", Prog. Chem. Appl. Chitin Its Deriv. 17: p. 5-20.
25. Nikolov S., Petrov M., Lymperakis L., Friák M., Sachs C., Fabritius H.O., Raabe D., Neugebauer J. (2010), "Revealing the Design Principles of High‐Performance Biological Composites Using Ab Initio and Multiscale Simulations: The Example of Lobster Cuticle", Advanced Materials. 22 (4): p. 519-526.